随着糖尿病患者不断增加,糖尿病引发的慢性难愈合性创面的发生率也在逐年升高。持续高糖微环境引起的血管生成障碍是导致糖尿病创面迁延不愈的重要原因。因此,促进创面血管再生,改善局部血液供应,是糖尿病创面治疗的关键。细胞外囊泡是天然纳米药物载体,可装载有效货物为糖尿病创面治疗提供新的策略。
近日,ACTA BIOMATER在线发表了解放军总医院付小兵/张翠萍团队的研究工作“VH298-loaded extracellular vesicles released from gelatinmethacryloyl hydrogel facilitate diabetic wound healing by HIF-1α-mediatedenhancement of angiogenesis”(2022 May 16. doi:10.1016/j.actbio. 2022.05.018)。该研究报道了利用GelMA水凝胶和细胞外囊泡作为小分子药物VH298的递送平台,增强了VH298向血管内皮细胞靶向递送的效率,提高了其促进创面愈合和血管再生的效果。解放军总医院付小兵院士和张翠萍副研究员以及湖北省太和医院李海红教授为论文共同通讯作者,博士研究生王亚希和博士后曹震为本文共同第一作者。

图1 GelMA缓释VH-EVs稳定HIF-1α激活内皮细胞促进创面愈合示意图
细胞外囊泡的双层脂质膜结构使其成为理想的药物递送载体。但天然细胞外囊泡因其自身所含内容物的复杂性和不确定性,治疗效果较为局限,通过细胞外囊泡的功能化改造可以进一步有针对性的提高其功能,优化应用。VH298是一种可以特异性阻断VHL蛋白与HIF-1α结合防止其降解的小分子化合物,可提高糖尿病创面内HIF-1α的表达水平,激活其介导的血管生成相关通路。但VH298存在的水溶性差、生物利用度低、细胞膜渗透快、体内应用药物浓度无法控制等问题直接影响了它的应用。然而VH298分子量小以及疏水性的特点为其提供了被装载进细胞外囊泡的优势条件。
在该研究中,作者采用37°C共孵育法构建了负载VH298的功能化细胞外囊泡(VH-EVs),然后对载药前后细胞外囊泡的形貌结构、粒径大小和表面标志CD63、CD9、TSG101等进行了表征,发现VH-EVs上述特征虽有部分改变,但仍符合细胞外囊泡的鉴定标准。在体外实验中,作者发现,与同等浓度的细胞外囊泡和单药VH298组相比,VH-EVs能有效促进内皮细胞的增殖、迁移和成管能力,而将VH-EVs组内皮细胞中的HIF-1α进行干扰敲低后,这一优势则被明显削弱,证明VH-EVs 携带的VH298通过增加HIF-1α含量发挥内皮保护作用。同时,该研究还将VH-EVs与光固化水凝胶GelMA混合制备成为一种具有良好力学性能和缓释性能的伤口敷料(Gel-VH-EV)。体内实验结果表明,Gel-VH-EV对VH298的缓释效应显著促进糖尿病小鼠创面血管新生,改善局部血液供应,发挥了最好的促创面愈合效果,其机制可能与HIF-1α/VEGFA通路激活有关。
推荐阅读:干细胞燃起糖尿病足患者的希望
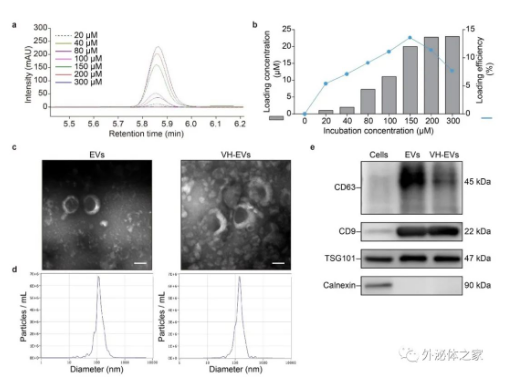
图2 天然细胞外囊泡与载药细胞外囊泡的特征鉴定

图3 干扰敲低HIF-1α后验证VH-EVs对血管内皮细胞功能的影响

图4 GelMA缓释VH-EVs有效促进糖尿病小鼠的创面愈合过程
推荐阅读:干细胞疗法几大经典案例
该研究构建了基于GelMA水凝胶和细胞外囊泡的小分子药物递送平台,有效改善了小分子的应用途径,提高了其生物利用度,并为糖尿病创面治疗及局部血管修复再生提供了新的治疗策略。
参考文献:VH298-loaded extracellular vesicles released from gelatinmethacryloyl hydrogel facilitate diabetic wound healing by HIF-1α-mediatedenhancement of angiogenesis, Acta Biomater . 2022 May16;S1742-7061(22)00287-2. doi: 10.1016/j.actbio.2022.05.018.










