1型糖尿病是由于免疫系统破坏了产生胰岛素的胰岛细胞,患者依赖胰岛素治疗,但长期胰岛素治疗仍然不能避免糖尿病并发症的发生和发展,并且胰岛素用量过高会导致低血糖发作,严重者可以威胁患者生命。
虽然胰岛移植可以有效治疗1型糖尿病,显著降低糖尿病严重并发症的发生和发展,但适合胰岛移植的胰腺供体严重短缺,限制了胰岛移植临床广泛应用。
推荐阅读:好消息!又一干细胞临床研究项目通过国家卫健委审批
IPS是具有多项分化潜能的干细胞,可以在体外通过诱导分化成为功能成熟的胰岛细胞,但分化效率低下一直是阻碍其发展的重要瓶颈。
邓宏魁研究团队大幅度优化了IPS向胰岛细胞的分化方案,重点解决了如何高效率地诱导从胰腺前体细胞向胰岛内分泌细胞命运特化的技术难题,从而使体外大规模制备功能成熟的胰岛细胞成为可能。
研究团队通过临床前期灵长类糖尿病模型,将人IPS来源的胰岛移植给糖尿病恒河猴,受体猴血糖控制水平较移植前得到明显改善,糖化血红蛋白显著下降,并且病理学检测结果显示移植的胰岛细胞存活并保持良好的功能。
推荐阅读:干细胞在干预糖尿病并发症方面的临床价值
更为重要的是,研究团队在灵长类动物实验周期内,未发现移植细胞发生致瘤现象,初步验证了人IPS来源的胰岛移植治疗方案的安全性。
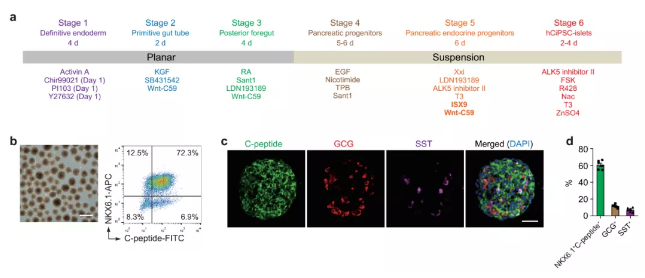
图1.人多能干细胞定向分化为胰岛细胞。
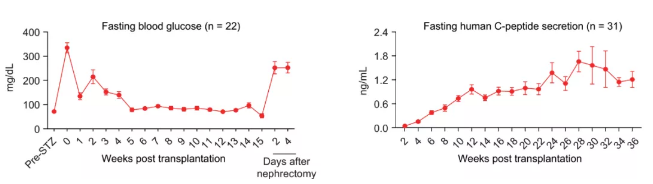
图2.人多能干细胞分化的胰岛细胞移植入糖尿病小鼠模型后逆转小鼠糖尿病。
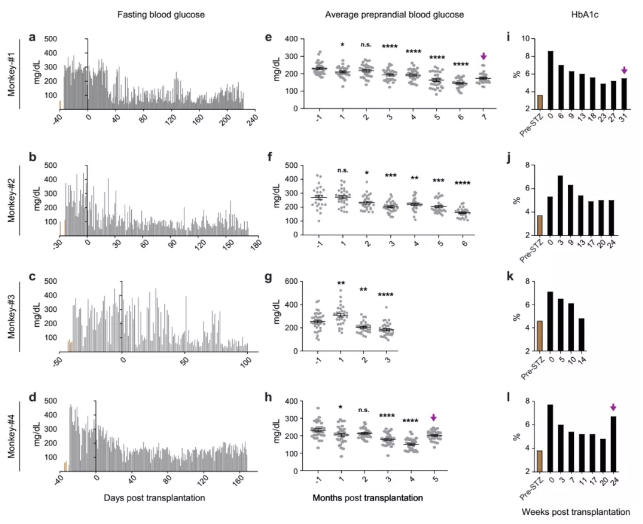
图3.人多能干细胞分化的胰岛细胞移植入糖尿病猴模型有效改善其血糖控制。
据本文共同第一作者,天津市第一中心医院器官移植中心王树森教授介绍,临床前期灵长类动物实验是IPS来源的胰岛移植临床研究的重要前期基础,可以较好地评估治疗方案的安全性和有效性,对后续临床研究的顺利实施具有十分重要的指导意义。
团队将继续优化IPS向胰岛分化及移植方案,系统性开展IPS来源的胰岛移植临床研究工作,力争早日让广大1型糖尿病患者受益。










