自2019年新冠疫情爆发以来,全球范围内确诊病例还处于不断攀升的阶段。截至2021年12月31日,全球已有超过2.828亿病例确诊。随着疫苗的大范围接种和中和抗体的使用,死亡率和住院率得到极大下降。但是有传播就会有突变,地球村的时代,任何一个国家出现特别强的突变株都会最终占领全世界,例如来自英国阿尔法,来自印度的德尔塔,到现在在南非发现的奥密克戎。
▲ 新冠刺突蛋白的立体图,从上到下依次是原始毒株,德尔塔变体,奥密克戎变体
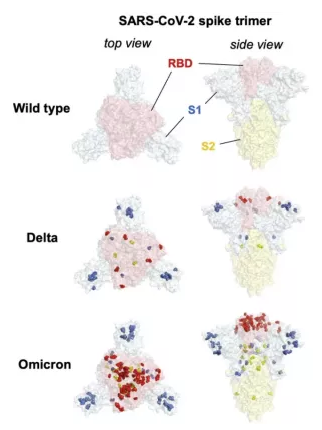
可以看出相对于原始毒株,德尔塔有9个突变分布在刺突上,而奥密克戎有密密麻麻34个,而且其中很多就是在刺突蛋白和抗体结合的表面上(红色点)。所以疫苗的保护作用下降和中和抗体药物失效也就在所难免。
推荐阅读:疫情防控丨多项案例:干细胞辅助治疗新冠肺炎安全可行!
新冠病毒可严重损害肺部,从轻度呼吸系统疾病到重症急性呼吸综合征、甚至死亡。目前对住院患者的治疗方法以支持性疗法和抗病毒疗法、抗菌疗法为主,对于满足指征的患者还可考虑应用免疫疗法。
近年来,间充质干细胞被广泛应用到了肺部疾病的治疗研究中。多项临床前研究已经证实间充质干细胞具有治疗急性肺损伤(ALI)、急性呼吸窘迫综合征(ARDS)的潜能。研究发现,人脐带间充质干细胞对H5N1感染的人肺泡上皮细胞的肺泡液清除率和蛋白质通透性具有明显的修复作用,此外,间充质干细胞外泌体可以通过RNA转移减少病毒复制,降低肺泡上皮细胞的死亡,缓解流感病毒导致的急性呼吸窘迫综合征症状。
2020年起国内外也展开了多个使用各类MSCs作为新冠患者治疗方法的临床实验。结果显示MSCs不仅显著降低了患者肺损伤,减少了恢复时间,而且在早期耐受性良好的情况下,提高了患者的生存率。其中,UC-MSCs作为MSCs中来源丰富、制备方便的选择,也吸引了诸多关注。
此前,王院士团队开展的UC- MSC治疗新冠重症患者的双盲、随机、安慰剂对照II期临床试验,共纳入100名患者。除了接受标准的治疗以外,患者分为接受UC-MSC治疗组(n = 65)和安慰剂(n = 35)治疗组。随访28天后,在第3、6、9、12个月,对所有患者进行后续随访,以评估治疗的安全性和有效性。
▲ 临床试验流程
研究结果显示,UC-MSCs给药3个月后对COVID-19重症患者的全肺病变仍有改善作用。与安慰剂组相比,在各随访时间点上,UC-MSCs给药组的肺实性病变获得更大缓解,其中第9个月差异最显著。在第12个月,有17.9% UC-MSCs组患者(10/56)CT图像正常,而安慰剂组中全不正常。此外,随访12个月期间,未观察到UC-MSCs输注相关的不良事件发生。UC-MSCs组和安慰剂组患者中不良事件发生率和评估的肿瘤标志物相似。
▲ 长期随访中UC-MSCs影响COVID-19重症患者6MWD的比较
6-MWD是一个反映复杂生理学综合储备能力的重要参数,包括肺和心血管系统以及神经肌肉循环。与安慰剂组相比,UC-MSCs组的患者在各随访节点上6-MWD数值均有增加。这可能由于UC-MSC给药后对肺部损伤的改善,肺部储备能力的恢复。
▲ 随访期间UC-MSCs组和安慰剂组症状和生命健康相关质量的比较
COVID-19患者发病6个月后仍会存在诸如疲劳、肌肉无力和睡眠困难等常见的症状。部分患者在出院12个月后仍可观察到肺部生理异常。与以前的研究一致,68.6%入组患者在为期12个月的随访中仍至少存在一种症状。与安慰剂组相比,接受UC-MSCs治疗的患者症状更轻和生活质量更好,睡眠困难、日常活动和NRS评分均得到显著改善。MSCs作用的潜在机制还没有完全阐明,推测可能是由于MSC分泌的肝细胞生长因子、血管内皮生长因子和角质细胞生长因子,促进了肺泡II型上皮细胞的再生,改善了肺部损伤。此外,MSCs可被相应的趋化因子吸引至炎症部位,然后通过直接接触和旁分泌作用调节各种免疫细胞的功能,发挥长期效应。
推荐阅读:【细胞前沿】综述 | 干细胞多方助力“抗疫” 有效治疗新冠症状及其后遗症
随着时间的推移患者体内中和抗体逐渐下降,在第12个月两组患者的中和抗体IR仍呈阳性,中位值抑制率相近(61.6%:67.6%),这表明UC-MSCs治疗未影响患者中和抗体的产生和维持。以上结果显示,UC-MSCs给药不仅取得了有益的短期疗效,还对COVID-19重症患者的肺部病变发挥了长期的治疗作用,同时具有良好的耐受性。










