目前干细胞的创伤治疗应用较多的是间充质干细胞(mesenchymal stem cells,MSCs),MSCs 是一种成体干细胞,分布于肌肉、肝脏、脂肪等多种组织,目前 MSCs 尚无公认的生物学标志,根据国际干细胞治疗协会的定义:贴壁生长;表达 CD73、CD90 和 CD105,不表达 CD34、CD45、CD14、CD19 和人类白细胞抗原-DR;体外可诱导分化为脂肪细胞、成骨细胞和软骨细胞。

MSCs 的多向分化潜能及旁分泌效应,能向皮肤细胞分化并参与愈合反应的各个阶段。(图 1)
MSCs 治疗基于多种机制:对损伤和炎症部位的定位,植入和分化为原有的细胞,释放旁分泌因子如组织修复因子、血管生成素、免疫调节因子。
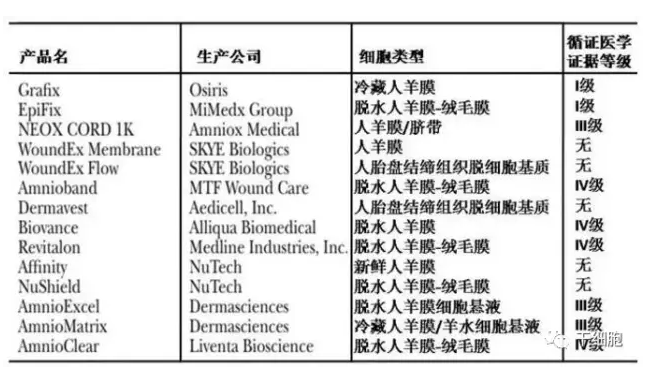
MSCs 干细胞疗法中最常见的材料为人胎盘的羊膜-绒毛膜组织,其含有丰富的 MSCs 干细胞且供体较容易获取,目前已有部分投入市场。(表 1)
表 1 市场上存在的人胎盘来源 MSCs 干细胞治疗产品
EpiFix(生产商:美国 MiMedx 公司)材料来源于脱水羊膜-绒毛膜,细胞无活性,产品以三维支架为结构,内含生长因子、细胞因子和多种细胞外基质蛋白,能引诱 MSCs 在伤口的聚集、迁移及增殖。Grafix(生产商:美国 Qsiris 公司)材料源于冷藏羊膜,保留新鲜的羊膜成分如成纤维细胞、MSCs、上皮细胞。上述干细胞产品在RCT研究中,都显示能明显促进慢性难愈性伤口的愈合。
目前干细胞疗法仍是新型疗法,Sorice 医生等提出 2 个关于干细胞治疗的关键问题:
对于治疗慢性难愈性创口,哪一种干细胞群可加速创口愈合同时减少瘢痕形成,且容易获取?
既往曾有研究对比骨髓来源(BM-MSCs)和脂肪组织来源(ASCs)的 MSCs ,两者的转录组和蛋白质组有 18% 的差异性,分析转录相关的基因发现两者有 13.2% 的差异。在免疫调节方面,ASCs 免疫抑制效果大于 BM-MSCs,但是无法判断这些差异性对于疗效的影响。
另外,不同的细胞提取、培养、处理技术也和干细胞群之间的差异有关。此外,关于使用自体或异体来源的干细胞仍具有争议。最初研究认为 MSC 具有免疫特权的特性,不产生免疫反应,所以认为异体细胞的干细胞库应用价值较大。
但目前证据显示,异体来源的 MSCs 仅仅是免疫排斥的速度较慢,自体干细胞的疗效更好。因此,笔者认为需要理清 MSCs 发挥治疗作用所需的时效,才能知道异体干细胞需要在体内存活多久才能发挥治疗效果。
如何将干细胞输送至损伤部位?
静脉注射是干细胞临床常用的给药方式,但是 MSCs 注射后会肺微循环停滞。目前较推荐局部应用,如局部注射、喷雾给药、使用三维支架等等。
综上所述,干细胞治疗是安全、有效的,可通过增加 MSCs 聚集于伤口,使陈旧性伤口重新启动正常愈合反应。虽然目前还有许多问题待解决,但其在慢性难愈性伤口治疗中优势是肯定的,随着技术不断改良,干细胞疗法或将成为慢性伤口的治疗标准。(来源:干细胞之家)










