胰岛素是调控血液葡萄糖浓度不可或缺的激素。当产生胰岛素的胰岛细胞受到破坏时,会导致胰岛素分泌不足和血糖稳态丧失,从而引发糖尿病。注射外源胰岛素能有效缓解高血糖,但无法实现对血糖的精准调控,同时会引起低血糖,诱发生命危险。胰岛细胞替代治疗(胰岛移植)是治疗糖尿病的有效策略之一。临床上,通过肝门静脉移植胰岛细胞,辅以免疫抑制剂,能让患者摆脱对外源胰岛素的依赖。然而免疫抑制剂的副作用,导致了该细胞替代治疗方案无法得到广泛的临床应用。目前,防止免疫排斥的新型解决方案有细胞封装技术、局部免疫调节和低免疫原性干细胞等。
美国康奈尔大学马明林教授团队在2021年开发了一种既安全又有功能的免疫隔离装置,用于胰岛细胞(包括人干细胞来源的胰岛细胞)的递送,实现了对外源胰岛细胞的长期保护。
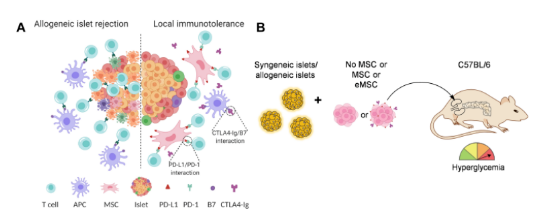
增强型间充质干细胞(eMSCs)局部免疫耐受诱导示意图
继该工作发表后,2022年7月22日,该团队在Science Advances期刊上发表了题为Engineered immunomodulatory accessory cells improve experimental allogeneic islet transplantation without immunosuppression的研究论文。该团队研发了一种功能增强型间充质干细胞,用于胰岛细胞的共移植。在不使用免疫抑制剂的情况下,实现了对外源胰岛细胞的长期保护、维持了胰岛细胞的功能和存活,实现了局部免疫豁免。该工作对于解决免疫排斥这一瓶颈问题具有重要意义,并可拓展至其他类型外源细胞递送的应用当中。相较于细胞封装技术,局部免疫调节的优势在于不引入外源性高分子材料,外源细胞能更好地与宿主融合,保证营养物质的传输等。
推荐阅读:国际期刊首曝!干细胞不但降血糖,还能保护血管,抵抗糖尿病并发症
研究者利用间充质干细胞(mesenchymal stromal cell, MSC)易于获取、易于培养和广泛应用于组织再生等特性,创新性地利用细胞编辑技术使间充质干细胞过表达免疫细胞调节蛋白programmed death ligand-1 (PD-L1) 和cytotoxic T lymphocyte antigen 4 immunoglobulin (CTLA4-Ig),从而显著增强了间充质干细胞的免疫调节功能,并诱导产生局部免疫豁免的移植环境。

表达 PD-L1 和 CTLA4-Ig 的 eMSCs 的体外表征
对比未经编辑的间充质干细胞(MSC),该增强型间充质干细胞(eMSC)在体外能显著抑制CD4+ T细胞和CD8+ T细胞的增殖与功能。对照组中,外源胰岛细胞移植到同种异体小鼠中,14天内被宿主免疫系统排斥。然而增强型间充质干细胞(eMSC)与外源胰岛细胞共移植到糖尿病小鼠体内,在不借助免疫抑制剂的情况下,能有效保护外源胰岛细胞长达100多天,维持小鼠正常血糖平衡(图2)。
推荐阅读:重磅 | 解放军总医院发布国人的干细胞治疗2型糖尿病二期临床结果
对比未经编辑的间充质干细胞,该功能增强型间充质干细胞在体内显著减少了CD4+ T细胞和CD8+ T细胞的产生和激活,并且显著促进调节型T细胞(Regulatory T cell, Treg)的生成,从而为外源胰岛细胞营造了一个局部免疫豁免的微环境,可避免免疫抑制剂的使用,为胰岛移植的临床应用提供切实可行的治疗方案。
康奈尔大学马明林教授为该论文的通讯作者,王茜博士为该论文第一作者,现哈佛大学博士后,从事干细胞来源胰岛细胞等研究。基于该研究已申请了一项美国专利保护。










